单细胞转录组技术综述
本文总阅读量 次
Abstract
普通转录组方法可类比于将一群细胞或一个器官的 RNA 提取混合,得到的是这些细胞平均的 RNA 表达量。而单细胞转录组研究则将每个细胞独立分离提取 RNA,并进行建库与测序,以此获得单个细胞特有的表达值。由于细胞内基因表达存在随机性与异质性,且组织或器官内含有多种不同类型的细胞,采用普通转录组方法进行测序时,这些细胞类型的差异可能会被平均化,从而难以区分。因此,单细胞转录组分析与普通转录组的关键区别在于,它关注的是单个细胞级别的表达情况,而非群体平均值。
单细胞测序技术的兴起,让人类得以以前所未有的精确度来观察细胞。然而,单次单细胞转录组测序(scRNA-seq)实验往往无法捕捉到所有细胞和基因的信息。单一模态的单细胞数据也无法充分解释细胞状态和系统变化。因此,单细胞数据的整合分析应运而生,旨在解决这两个问题。通过整合不同来源的 scRNA-seq 数据,我们可以汇集完整的细胞类型,从而为构建细胞图谱提供强有力的支持。同时,整合多个模态的单细胞数据,我们能够探究不同模态之间的因果关系和基因调控机制。数据整合方法的研发和应用,有助于充分挖掘单细胞数据的丰富性和相关性,揭示有价值的生物学变化。基于这些考虑,本文概述了多源 scRNA-seq 数据整合和单细胞多模态数据整合的基础原理、方法及其应用,分析了现行方法的优缺点,并对未来的发展方向进行了展望。
Keywords: 转录组测序,单细胞转录组测序,多模态,数据整合,细胞类型,细胞图谱
引言
生物体由不同形态和具有特定功能的细胞构成,而不同细胞的基因表达模式也是不同的。常规的植物转录组学研究通常是将植物整个器官或组织均质化后进行测序,忽略了细胞的异质性。虽然这种方法有助于在器官或组织水平上解决许多生物学问题,但是无法了解稀有细胞类型或单个细胞的转录过程。单细胞测序技术可以从单个细胞层面获取信息,解决了传统群体细胞测序技术所掩盖的细胞异质性问题。这种技术使得研究精度从群体细胞级别提升到单个细胞级别,对于深入了解细胞异质性和生命活动至关重要。细胞捕获、测序技术和生物信息学的快速发展使得单细胞转录组测序(Single-cell RNA-seq,scRNA-seq)成为可能,并不断发展和完善。目前,scRNA-seq 已广泛应用于生物学和医学领域,并在植物学研究中显示出巨大的潜力。在植物中开展单细胞转录组研究有助于深入理解不同细胞类型在发育过程中的作用以及细胞间的调控网络。本文概述了植物单细胞转录组测序和数据分析,以及单细胞转录组测序在植物研究中的应用。
1 单细胞测序技术概述
1.1 单细胞测序技术的发展
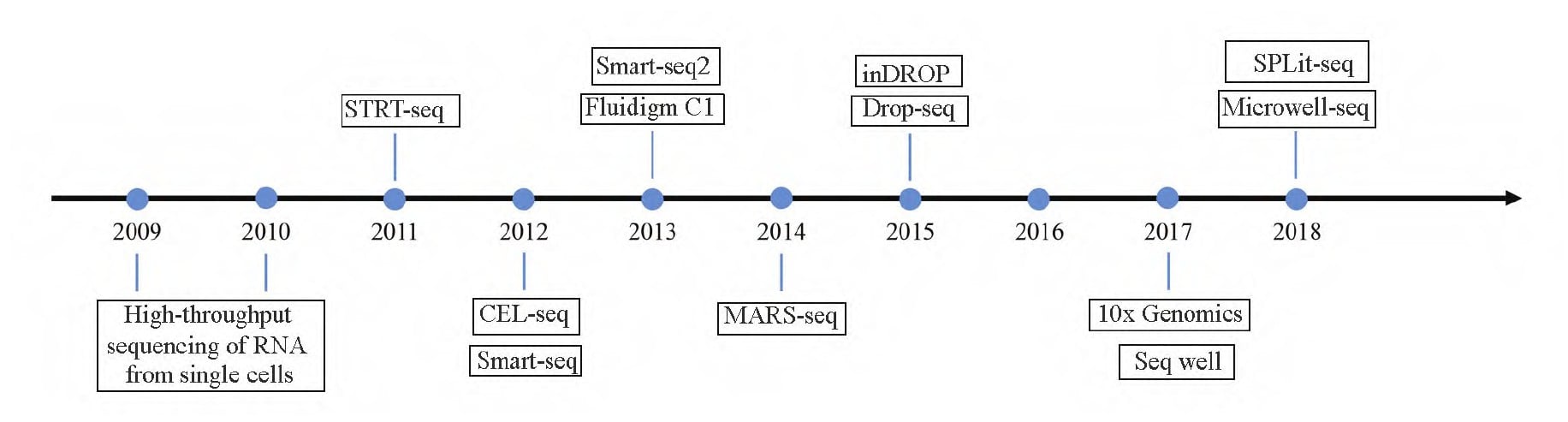
以 1977 年 Frederick 等开发的第一代测序技术为起点,人类正式进入基因组学时代。第一代测序技术的主要特点是测量序列读长可达 1 kb,精确度接近 100%,但因测序价格高、通量低等方面的不足,未能被大规模应用。为解决第一代测序技术存在的问题,经过科研人员长期探索改进,第二代测序技术成功开发。第二代测序技术在提高测序速度和精确度的基础上,降低了成本,但冗余扩增和损失等问题也逐渐浮现,导致其覆盖率较低,并且具有系统偏向性。随着科学技术的发展进步,第三代测序技术在避免前两代测序技术的缺点的前提下,将两代的优点进行了集成。第三代测序技术无需进行任何基因组或转录组扩增,只需使用单个细胞直接进行测序,避免了 PCR 过程中的扩增误差,同时提高了序列读长和测序速度,使得成本得以降低。然而,真核多细胞生物的细胞具有固有的异质性,直接对细胞群体进行测序分析的结果只是所有细胞的平均表达信号,一些异质性细胞的表达情况被掩盖和忽略。许多研究表明,即使在非常相似的细胞种类中,基因表达也具有差异化。为了完全了解和辨别复杂细胞群的异质性,必须对大量单个细胞进行测序分析。基于基因组学、转录组学和表观基因组学的测序技术更多地集中于研究单个细胞而非细胞群体。单细胞测序技术可以高精度地发现细胞存在的异质性和罕见细胞,揭示复杂组织中细胞类型的发展和分化,评估单个细胞之间的基因表达差异。
随着单细胞分离技术的不断改进和测序通量、准确性以及灵敏度的提高,各种新的测序技术不断涌现。目前常用的 scRNA-seq 技术包括 CEL-Seq、Smart-Seq、SCRB-Seq、10×Genomics、Drop-seq 和 inDrop 等。
植物细胞具有细胞壁,测序时会对分离出的单细胞造成干扰,同时,在植物中区分细胞亚群的特征表达基因并不明确。因此,scRNA-seq 技术在植物研究中的应用滞后于动物研究。Brennecke 等人率先提出使用 scRNA-seq 技术辅助植物细胞分子机理研究。目前,包括 10×Genom-ics、Drop-seq、Smart-seq2 和 CEL-seq2 等技术已成功应用于拟南芥、水稻、玉米等物种的单细胞研究。Smart-seq2 和 CEL-seq2 方法不受单个细胞大小、形状和同质性的影响,样本间交叉污染较低,能够处理稀有细胞类型,但对于低表达水平的基因可能造成信息丢失,因此适用于样品容量较小的实验设计。而 10×Genomics 方法能够集单细胞分选、扩增、建库于一体,具有细胞通量高、测序覆盖度高、精准度高、单细胞捕获效率高、建库周期短的特点,已经成为植物单细胞测序的主流方法。
除了单细胞测序技术的快速发展,一些稳定可靠的生物信息学分析方法也是促进 scRNA-seq 在植物组织发育研究中应用的有利条件。常用的数据分析软件有 Loupe Browser,该软件能够实现对细胞亚群特征表达基因列表的查看、细胞亚群的可视化展示以及多样本之间的比较等功能。此外,还有基于 R 语言开发的多种软件包用于 scRNA-seq 测序的数据质量控制、聚类分析、基因注释和差异分析等过程,例如 Seurat 软件包、Monocle 软件包和 clusterProfiler 等。
1.2 单细胞转录组测序原理
scRNA-seq 自问世以来成为解决单细胞分辨 率下高通量评估基因表达异质性的有效途径之一, 并逐步应用于不同类型动植物遗传发育机理研究。 其原理是通过将植物细胞制成原生质体,之后利 用微流体、油滴包裹、条形码标记等技术实现高通 量的细胞捕获。这样可以分离并标记单个细胞,从 而对单细胞转录组进行扩增。再通过构建文库并对 单细胞转录组进行高通量测序,可以获得细胞内数 万个基因表达信息。同时能够分辨不同细胞亚群的 转录组特征,从而揭示细胞间基因表达的异质性。 其技术核心是单细胞的分离捕获以及用极微量的 mRNA 逆转录出 cDNA。相比于 bulk RNA-seq,scRNA- seq 能够在单个细胞水平上构建每个细胞的表达 谱,从而揭示单个细胞的基因表达状态、反映细胞 间的异质性。该技术不仅对植物组织中低丰度表达 信息和稀有细胞类群具有较高检测灵敏度,而且对 于深入了解细胞分化发育过程中的时空尺度表达 规律具有重要价值。
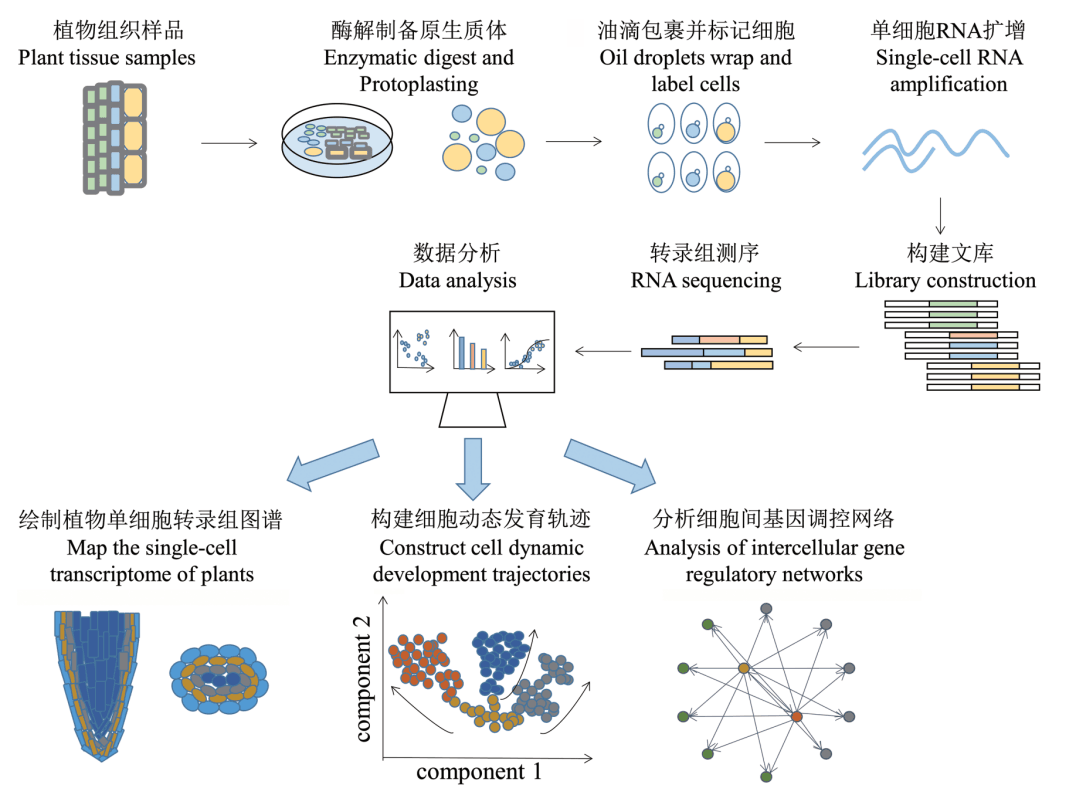
2 单细胞转录组技术流程
2.1 scRNA-seq 的样品制备
单细胞技术的第一个挑战是高效对单个细胞进行物理隔离。最近的研究在许多不同植物物种中采用酶解细胞壁的方法从组织中释放原生质体。这种方法可以使原生质体免受细胞壁的干扰,从而进行单细胞基因组或转录组分析。此外,可以分离出原生质体的核或交联核用于分析。然而,坚硬的细胞壁仍然是植物单细胞技术的主要障碍。由于原生质体在隔离过程中必须保持存活,并且受到最小程度的干扰,所以细胞壁酶解过程需要根据所研究的组织进行优化。因此,已经开发了不同的细胞壁消化方案,以从不同的植物组织中释放原生质体,包括拟南芥、番茄和水稻。同时还在努力寻找更广泛适用的原生质体分离方案。与原生质体隔离相比,核的隔离更为稳健,并且可以适应更广泛的组织类型和物种。可以在液氮中冷冻组织,甚至在进行细胞核隔离之前进行固定,以防止隔离过程诱导一些基因在应对压力时的表达。与原生质体一样,分离的细胞核可以用于进行 RNA 测序,称为单核 RNA 测序(snRNA-seq)。尽管 snRNA-seq 更为广泛适用且不太可能受到隔离过程的影响,但与单细胞 RNA 测序(scRNA-seq)相比,它捕获的转录本数量较少,并且在 snRNA-seq 数据中发现更多的不成熟 mRNA。
在目前普遍存在的不同种类的流式细胞仪中,应用最广泛的是荧光激活细胞分选(FACS)系统。每个细胞都具有不同的物理、化学或光学特性,正是由于这些性质,才将不同的细胞区分开来。当细胞以较高的速度通过激光束时,通过下游使用光学检测器来捕获上游产生的激光束传递过来的特定细胞信号。经过分析,细胞悬浮在一个由小通道组成的封闭系统中,在压力的驱动下细胞流通过直径微米级的小喷嘴,随后成为具有前进动力的液体射流。利用电磁波或超声波等振动力量,该射流成为分散的飞行液滴流。通过利用带电板的偏转吸引携带特定细胞的液滴,最终将液滴收集至通常为管或微孔板的容器中。该技术可对具有差异化的细胞进行快速分选,并且提供了较高的准确性。
激光捕获显微切割(LCM)是一项先进的技术,用于从大部分固体组织样本中分离单个细胞或细胞室。通过目视识别靶细胞或隔室后,利用显微镜观察进行组织切片。实验员通过在线选取要切断的部分来画线。沿着所画的线,激光切割组织从而获得所需的单个细胞。该技术需要保持细胞处于悬浮状态并具有活性,操作较为复杂,在操作过程中容易出现失误,导致无法完全确定所需细胞是否真的被转移到基质中或被转移的细胞是否纯净无杂质,因此获得的单个细胞纯度较低。
微流控技术是利用油包水的方式进行单个细胞的分离。首先,通过控制液滴的流动速度来捕获单个细胞。然后,利用单个细胞隔离系统,基于喷墨的方式进行单个细胞打印。这种单个细胞打印机(SCP)使用成像系统和自动物体识别算法来检测微流控分配器芯片中的细胞,该芯片可以产生类似喷墨打印机的液滴。在芯片的喷嘴中对细胞进行分类,然后在微滴(直径 60 μm)内喷射,以沉积到各种基板上,不含细胞或含有多个细胞的液滴在飞行过程中通过真空抽吸转向废物容器。该技术不仅能够快速、准确地从样品中分离出单个细胞,而且还可以在细胞样本和试剂的体积非常小的情况下运行。从经济角度来看,该技术对于稀有细胞应用是十分有利的。
2.2 scRNA-seq 文库构建和测序
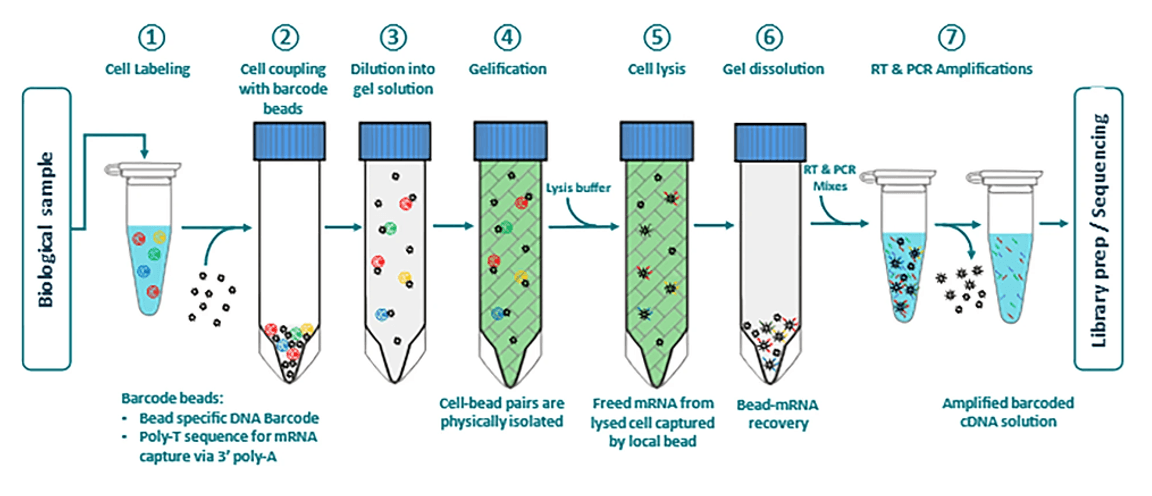
多种文库制备方法已应用于植物 scRNA-seq 研究。其中,10x Genomics 系统被广泛用于构建多种植物的 scRNA-seq 文库,已用于分析来自各种植物组织的 5,000 至 20,000 个细胞。10×Genomics 是一种以微流控技术为基础的单细胞转录组测序技术。它允许在全基因组范围内进行检测,并对数千个细胞进行表达图谱分析。首先,将装有引物和条形码寡核苷酸的凝胶珠与细胞和试剂混合。然后,在微流控接头处与油表面活性剂溶液混合在微流控芯片的一个通道中,细胞与试剂结合形成凝胶珠,从另一个通道中提取凝胶珠。将提取出的凝胶珠溶解以释放其寡核苷酸,在每个液滴内部进行多聚腺苷酸化的 RNA 反转录。反转录出的条形码互补 DNA(cDNA) 自身扩增后在进行 PCR 扩增,将获取的 cDNA 构建序列文库并进行 Illumina 短读测序。10×Genomics 平台覆盖细胞的范围更广,更容易在测序过程中检测出罕见的细胞类型。但是,它只能对 DNA 3’端进行读序,需要的活细胞较多且操作过程较复杂。
另一种文库制备方法是 Smart-Seq,其中在低渗溶液中裂解每个细胞,并使用寡核苷酸 (dT) 引发和智能模板转换技术将聚 (A)+RNA 转化为全长 cDNA。随后进行 12~18 个周期的 cDNA PCR 预扩增,在经过初始 cDNA 合成步骤后,将扩增后得到的 cDNA 进行标准 Illumina 测序文库构建。与以前的单细胞转录组方法相比,Smart-Seq 显著提高了阅读覆盖率。
在 Smart-seq 技术的基础上又开发出了 Smart-seq2。其技术核心是引进莫罗尼小鼠白血病病毒逆转录酶 (MMLV-RT)。MMLV-RT 是一种新的逆转录酶,具有可进行逆转录 (RT) 和模板转换 (TS) 等 2 个先天特性。模板转换表示 MMLV-RT 在 RT 反应期间到达 RNA 模板的 5’端时引入一些未模板核苷酸的能力。这些额外的核苷酸作为辅助寡核苷酸 (“模板转换寡核苷酸”,TSO) 的对接位点,在其 3’端携带 2 个核糖鸟苷酸和 1 个锁定核酸 (LNA) 鸟苷酸。这种特殊的碱基结构对于 TSO 和胞嘧啶尾之间的稳定退火起关键性作用,并且是 MMLV-RT“切换模板”和使用辅助寡核苷酸作为模板合成 cDNA 链所必需的。之后通过 Illumina 测序技术进行测序。与 Smart-seq 相比,Smart-seq2 转录组文库具有更好的检测性、准确性、可扩展性和覆盖率,并且具有较低的成本。
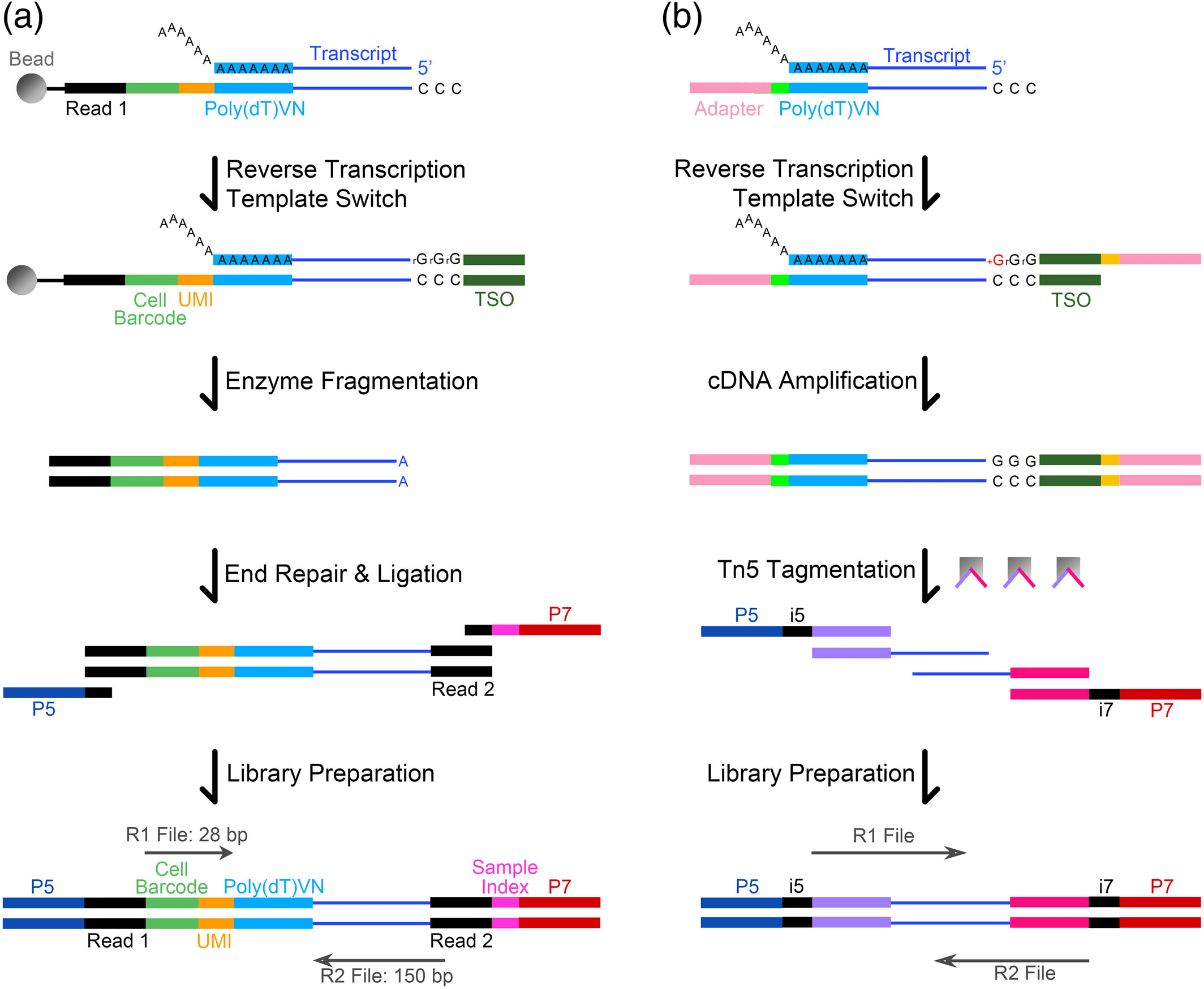
除了常用的 10x Genomics 系统和 Smart-seq 外,其他方法也在植物中显示出 scRNA-seq 的巨大潜力。例如,Nextera XT DNA 文库制备试剂盒 (Illumina) 用于 scRNA-seq 文库构建,以分析来自拟南芥根的超过 12,000 个细胞。最近,BD Rhapsody 系统利用基于微孔的卡盒捕获广泛的单细胞,从而能够同时测量多个方面,包括基因表达和蛋白质丰度。这种方法被用于分析来自水稻花序的 37,571 个细胞,从而形成早期花序发育的全面基因表达图谱。使用各种方法构建的 scRNA-seq 文库已使用 Illumina 测序技术进行测序,例如 HiSeq、NextSeq 和 NovaSeq。
| 物种 | 样品制备 | 文库构建方法 | 测序平台 |
|---|---|---|---|
| 拟南芥 | 根原生质体 | Chromium Single Cell 3′试剂盒 v2(10x Genomics) | Illumina NextSeq |
| 拟南芥 | 根原生质体 | Chromium Single Cell 3′试剂盒 v2(10x Genomics) | Illumina HiSeq |
| 拟南芥 | 根原生质体 | Nextera XT DNA Library Kit (Illumina) | Illumina HiSeq 和 NextSeq |
| 拟南芥 | 叶原生质体 | Chromium Single Cell 3′试剂盒 v2 和 v3(10x Genomics) | Illumina HiSeq |
| 拟南芥 | 茎原生质体 | Chromium Single Cell 3′试剂盒 v3(10x Genomics) | Illumina NovaSeq |
| 水稻 | 根原生质体 | Chromium Single Cell 3′试剂盒 v3(10x Genomics) | Illumina NovaSeq |
| 水稻 | 叶原生质体 | Chromium Single Cell 3′试剂盒 v2(10x Genomics) | Illumina NovaSeq |
| 水稻 | 叶和根原生质体 | Chromium Single Cell 3′试剂盒 v3(10x Genomics) | Illumina HiSeq |
| 水稻 | 花序和叶原生质体 | The BD Rhapsody system | Illumina 测序仪 |
| 玉米 | 根原生质体 | Chromium Single Cell 3′试剂盒 v3(10x Genomics) | Illumina HiSeq |
| 西红柿 | 茎尖原生质体 | Chromium Single Cell 3′试剂盒 v3(10x Genomics) | Illumina Novaseq |
| 杨树 | 茎尖和茎细胞核 | Chromium Single Cell 3′试剂盒 v3.1(10x Genomics) | Illumina Novaseq |
2.3 scRNA-seq 数据分析
单细胞RNA测序(scRNA-seq)实验产生的是复杂且高维度数据,这需要专门的流程来进行分析与解读。单细胞数据分析通常包括一系列步骤,如数据预处理、序列比对(或基因表达定量)、质量控制、数据归一化、缺失值插补、数据降维、数据整合、细胞聚类、差异表达基因分析以及后续的功能研究。
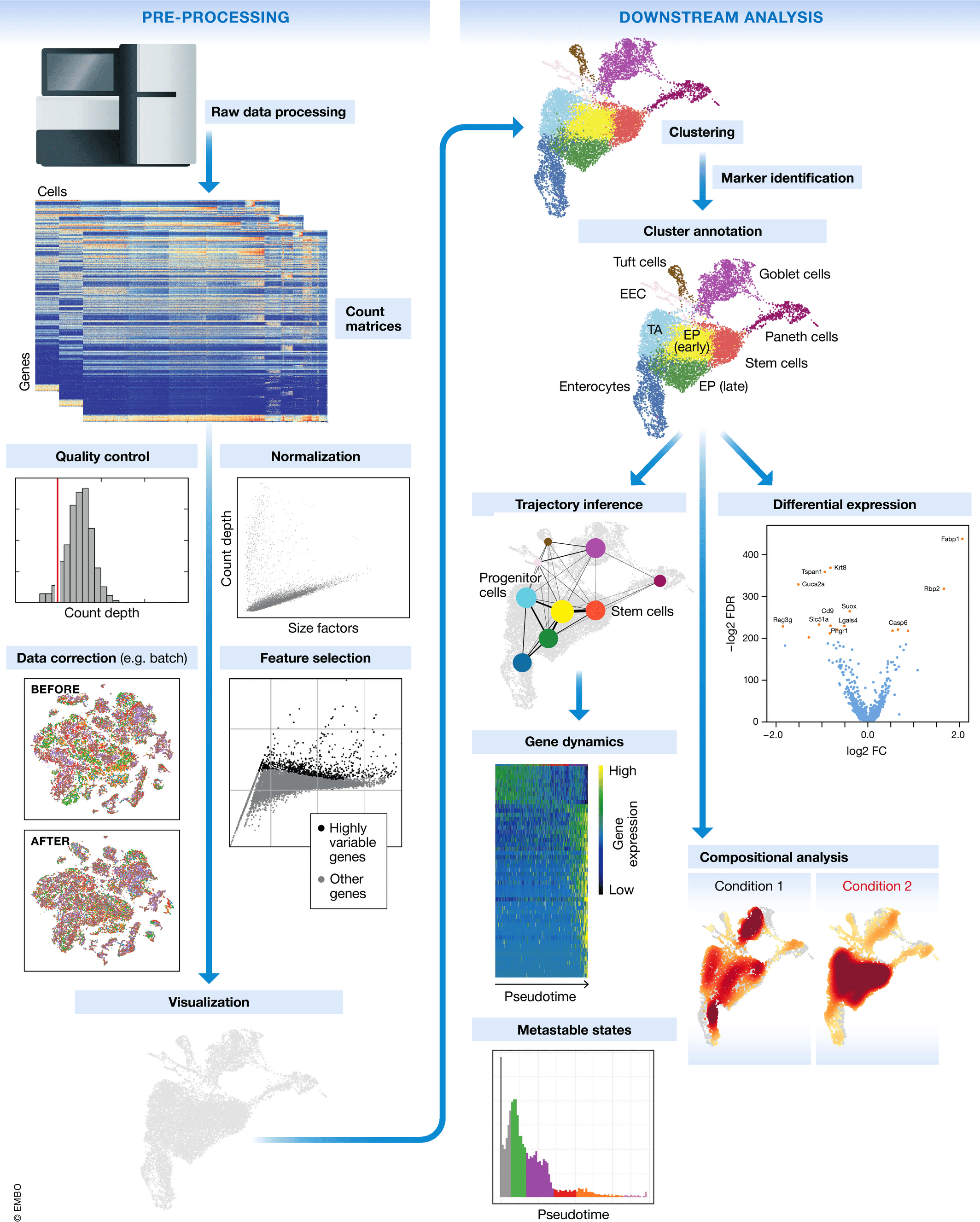
预处理:预处理步骤包括过滤掉读取质量低以及修剪低质量的碱基。
读取比对:针对 scRNA-seq 数据,最常用的读取比对工具有 Cellranger、STARsolo 和 Kallisto。Cellranger 包含了一个改进的 STAR,其效率不如 STARSolo,但无论选择哪种比对工具,读取都会与参考基因组比对,并通过 UMI 折叠,得到一个整数特征计数的基因-细胞矩阵。
质量控制:质量控制步骤包括去除双细胞/多细胞(来自 2 个或更多细胞的文库)以及去除外泌 RNA(来自非条形码裂解细胞的 mRNA)的污染。双细胞和多细胞严重混淆了 scRNA-seq 数据分析,目前已经开发出几种工具用于它们的检测,如 DoubletFinder 和 SoCube。外泌 RNA 污染是 scRNA-seq 数据中的一个重要问题,尤其是在基于单核分离的方法中,这会导致细胞裂解。
标准化:scRNA-seq 数据的标准化通常分为两步。首先,通过将每个细胞的特征计数除以该细胞的总计数来缩放,解决基因特异性偏差,如相对基因丰度,然后对所有表达值进行等量缩放。这一步类似于典型的 bulk RNA-seq 缩放步骤。其次,对所有的特征计数应用变换(通常是 log 变换)以稳定方差。样本间标准化可以通过两种类型的方法执行:(a) 全局缩放方法,包括简单的 CPM 转换和其他更稳健的缩放程序,如 DESeq2 的标准化方法和 PsiNorm。(b) 非线性方法,如 Linnorm,sctransform 和 Dino。
数据整合与批次效应校正:批次效应是测量的表达水平的变化,这是处理不同组或“批次”中的细胞的结果。例如,如果两个实验室从同一队列中采集样本,但这些样本的解离方式不同,则可能会出现批次效应。如果实验室 A 优化其解离方案以解离样品中的细胞,同时最大限度地减少对细胞的压力,而实验室 B 没有这样做,那么 B 组数据中的细胞很可能会表达更多与压力相关的基因。一般来说,批次效应的来源多种多样且难以确定。一些批次效应来源可能是技术性的,例如样品处理、实验方案或测序深度的差异,但供体变异、组织或采样位置等生物效应也可以被解释为批次效应。是否应考虑生物因素带来的批次效应取决于实验设计和所提出的问题。
降维:降维步骤将高维数据投影到低维空间,以可视化细胞簇的结构和推断细胞发育轨迹。目前已开发了多种基于线性和非线性模型的方法以及深度学习算法进行降维。最常用的方法是均匀流形近似和投影,它为细胞类型簇提供了最佳的组织,并且计算成本最低。
聚类和细胞类型鉴定:为了在 scRNA-seq 实验中将与细胞类型或状态相似的细胞分组,它们根据基因表达模式被分为簇。聚类由两个步骤组成,从基因-细胞计数矩阵生成图并在该图上进行聚类。广泛使用的图嵌入方法是 kNN 方法,还有一些其他的图生成方法,包括可解释的人工智能方法,如 iRF-LOOP 和 CoMet。有许多常用的图聚类方法,其中 k-means,层次聚类,Leiden 算法和马尔可夫聚类是最常用的。一旦基于图拓扑将细胞分为簇,就可以根据簇内的前几个差异表达基因 (DEG) 为每个簇分配一个细胞类型。
差异表达和功能分析:差异表达分析发现细胞群中基因表达的变化,其表现出由不同细胞类型、不同 mRNA 含量和不同细胞状态引起的多模式和异质模式。最新研究的中的基于负二项分布混合模型的单细胞差异基因表达方法,例如 glmmTMB 和 NEBULA-HL,优于其他几种方法。然后,可以进行功能分析以推断细胞类型水平上的基因、基因模块/网络或通路的功能。一般来说,该步骤包括基因集富集分析和功能富集分析。
3 单细胞转录组技术在植物组织研究中的应用
3.1 在细胞水平上探究植物对非生物和生物胁迫的反应
植物面临各种不同的非生物和生物胁迫,例如干旱、淹水、盐碱、冷冻/寒冷、高温,以及各种病原体。不同的细胞类型对环境条件表现出不同的应对方式,有些细胞对胁迫表现出比其他细胞更强的恢复力。然而,特定细胞类型如何对不同的环境信号做出反应,并与其他细胞建立沟通以增强存活,目前尚不清楚。单细胞 RNA 测序(scRNA-seq)已被用来研究植物中细胞类型特异的基因表达对非生物胁迫的影响。例如,利用 scRNA-seq 对受到热应激的拟南芥幼苗进行分析表明,虽然各细胞类型的热应答表达主要受典型的热休克基因驱动,但在其他基因表达方面,不同细胞类型间可以观察到微妙而显著的差异。此外,对水稻幼苗的茎和根受到不同非生物胁迫(高盐、低氮和缺铁)的 scRNA-seq 分析显示,这些胁迫主要以细胞类型特异的方式影响基因表达,而非造成基因表达的显著变化。在给定的细胞类型中,同一组基因在转录水平上受各种胁迫的调控。
scRNA-seq 也被用来研究由细菌和真菌病原体以及昆虫引起的生物胁迫下植物的应答。例如,最近一项研究利用 scRNA-seq 分析了叶片被假单胞菌感染的拟南芥的转录组。这项分析发现了表现出免疫、过渡和易感状态的不同病原体响应细胞团簇,提供了关于疾病进展的分子机制的见解。此外,对拟南芥叶片组织在对抗真菌病原体 Colletotrichum higginsianum 的应答中进行的 scRNA-seq 分析揭示了细胞类型特异的基因表达,阐明了表皮表达的 MYB122 在抗病性中的作用。另外,比较不同水稻品种对褐飞虱(Nilaparvata lugens)的 scRNA-seq 分析突出了易感(TN1)和抗性(YHY15)水稻品种之间叶鞘细胞和韧皮部实质细胞等细胞类型的显著差异。
3.2 绘制植物单细胞转录组图谱
通过单细胞转录组测序 (scRNA-seq) 技术绘制遗传图谱,不仅可以帮助了解特定组织中的细胞组成类型及其遗传发育规律,而且不同细胞亚群的转录组信息能够为分析细胞功能提供可靠依据。scRNA-seq 技术最初在动物的肺、小肠和肾脏等多种组织器官分化研究中应用广泛。随着细胞分离技术的成熟和测序技术的快速发展,scRNA-seq 图谱在植物中的研究应用也逐步从模式植物拟南芥扩展到大田作物。有研究通过建立拟南芥叶片维管系统的单细胞转录组图谱,迈出了研究特定拟南芥叶片细胞类型和理解维管细胞表达图谱的重要一步,并为将来挖掘叶细胞发育相关功能基因提供了重要的遗传资源。
近两年来,单细胞转录组图谱逐渐应用于水稻、玉米、番茄、茶树等作物的遗传发育研究中。有研究通过对 237,431 个细胞的转录组测序,鉴定出单子叶植物水稻的叶片和根部中 15 种和 9 种亚细胞类型,并绘制了水稻叶片和根部的单细胞转录图谱。通过比较非生物胁迫下叶和根组织中不同亚细胞簇基因表达水平的差异,探究了细胞类型表达特异性与细胞比例的关系,为理解水稻发育和胁迫响应的转录调控规律提供了新的认识。
通过绘制不同类型植物单细胞基因表达图谱,可以更全面地了解不同细胞亚群的表达特点,为将来研究植物细胞功能的分子机理提供有力支持。
3.3 在细胞水平上揭示植物的表观遗传调控
表观遗传学修饰,如 DNA 甲基化和组蛋白修饰,在植物基因表达的调节中扮演着关键角色。虽然全球基因表达的表观遗传学调控机制已经受到了广泛的关注,但在植物中,这一调控机制在单细胞层面的作用还未被充分探索。目前,单细胞表观基因组学及其兴起的使用主要集中在动物研究领域。例如,单细胞 RNA 测序(scRNA-seq)和转座酶可及染色质测序分析(ATAC-seq)已被用于研究小鼠的心脏祖细胞,帮助人们深入了解心脏祖细胞命运决定过程中的转录和表观遗传调控机制。同样,对人类免疫表型血细胞进行综合的 scRNA-seq 和 ATAC-seq 分析显示,在造血干细胞/多能祖细胞分化之前,存在广泛的表观遗传启动,而不仅仅是转录启动。受到这些哺乳动物研究案例的启发,可以将相同的策略应用于植物单细胞表观基因组学的研究。scRNA-seq 可以与其他表观遗传分析技术,如染色质免疫沉淀测序(ChIP-seq)、ATAC-seq 或亚硫酸氢盐测序(Seq)结合使用,以在单细胞层面分析基因表达与表观遗传修饰之间的关系。例如,对小麦根样本的综合 snRNA-seq 和 ATAC-seq 分析,已经揭示了不对称基因转录和根毛分化过程中特定的细胞类型调控网络。总的来说,scRNA-seq 正在成为一种强大的工具,能够帮助人们深入理解植物中基因表达与表观遗传调控之间的联系。
3.4 了解植物的细胞命运决定和器官发生
植物细胞命运的决定是一个复杂的过程,涉及各种信号通路和调控机制。在生长过程中,细胞向特定细胞类型的分化是由其特定基因的表达决定的,这些基因受到各种转录因子和信号分子的调控。单细胞 RNA 测序(scRNA-seq)在揭示植物细胞命运决定的分子机制方面具有重要潜力。有研究使用 scRNA-seq 在棉花(Gossypium hirsutum)的胚珠外被四个发育阶段中分析基因表达,确定了两种转录因子(类 MYB25 和 HOX3)在纤维分化和尖端偏向扩散生长中的关键作用。此外,最近一项 scRNA-seq 分析对可再生棉花品种 Jin668 和难于再生的 TM-1 的子叶组织进行了研究,揭示了主要维管细胞类型在对外部刺激中进行细胞命运转变中的重要作用,并鉴定了一些与再生有关的新型基因,包括 CSEF、PIS1、AFB2、ATHB2、PLC2 和 PLT3。为了研究主导植物侧向生长的木质部细胞的发育,Tung 等人进行了四种植物物种的比较空间转录组分析,全面了解不同植物物种中木质部细胞谱系的形成过程跨越了大范围的进化空间。
4 单细胞转录组测序在植物上应用存在的问题与挑战
尽管单细胞 RNA 测序 (scRNA-seq) 对于植物系统和合成生物学研究具有巨大的潜力,仍然存在一些技术挑战。包括样品制备、文库构建、数据分析以及数据共享和利用方面。植物细胞由坚硬的细胞壁包围,这对于在 scRNA-seq 中提取细胞核或原生质体造成了影响。为了克服这一挑战,需要进一步发展有效的细胞解离方法来制备细胞核或原生质体样品。同时,分离的原生质体的产量和活力会受到多种因素的影响,包括组织质量、基因型、生理状态和应激反应,因此需要优化分离条件以提高产量和活力。
与 scRNA-seq 相比,snRNA-seq 在分析复杂植物组织时具有一定优势,特别是在植物细胞壁对原生质体分离提出挑战的情况下。最近的研究报道了一种高质量细胞核分离方案与高通量 snRNA-seq 兼容。然而,分离完整的植物核可能具有挑战性,因此需要精心处理和优化裂解缓冲液成分和离心参数以保持核的完整性。
面对植物细胞体积较大的挑战时,一些新的 scRNA-seq 技术可能为提供潜在解决方案。例如,RevGel-seq 是一种突破性的方法,可以在人和小鼠细胞中高效进行样品制备,无需使用特定仪器。类似的技术可能有助于克服植物细胞体积带来的挑战。此外,建立一个标准化的植物空间单细胞基因组数据库,包含来自不同植物物种和发育阶段的基因组和 scRNA-seq 数据,也可以帮助解决数据分析中的一些挑战。
非模式物种中缺乏充分表征的细胞类型特异性标记基因是 scRNA-seq 数据分析的主要挑战。此外,许多植物物种的参考基因组不完整或注释不良可能会阻碍 scRNA-seq 数据的准确绘制和解释。细胞间的异质性需要生成大型数据集和强大的生物信息学管道,以准确识别不同的细胞类型。然而,目前缺乏使用来自大量植物物种的 scRNA-seq 数据对细胞类型同源性和多样性进行分类的计算方法。应对这一挑战的一个解决方案是建立一个标准化的植物空间单细胞基因组数据库,纳入来自多个物种不同发育阶段的最新 T2T(端粒到端粒)基因组、基因注释和 scRNA-seq 数据。环境条件以标准化格式。
总的来说,尽管在植物系统中进行 scRNA-seq 研究存在一些技术挑战,通过持续的方法优化和技术改进,这些挑战是可以克服的,从而促进对植物细胞的深入理解和应用研究。
展望
ScRNA-seq 已广泛应用于动物、医学等领域,并在细胞分化、重编程、癌症诊断等方面突破了瓶颈。相较于动物、医学领域,植物领域的 scRNA-seq 研究仍处于起步阶段。目前,scRNA-seq 技术主要用于构建植物细胞图谱和细胞发育轨迹的建立,主要针对拟南芥、水稻等模式植物。与动物细胞研究不同的是,植物细胞的研究主要集中在非生物胁迫下的反应机制。非生物胁迫是影响植物生长和发育的重要环境影响因素。通过 scRNA-seq 技术来探究不同胁迫条件下植物细胞亚群的表达谱变化,从而解析植物非生物胁迫反应机制,有利于了解植物细胞发育的机理。
目前,植物 scRNA-seq 技术应用还存在一些挑战,如单个细胞分离困难、转录组扩增不完整,基因开发不足等。同时,高质量、高效的生物信息学方法也需要进一步完善。随着 scRNA-seq 技术的持续发展,其在植物应用中将实现更快更深的转录组信息挖掘一个将在挖掘细胞分化路径、发现新的细胞亚型、探究植物生长发育的基因调控网络以及非生物胁迫下的植物响应机制方面发挥重要作用。此外,植物 scRNA-seq 技术将会从拟南芥、水稻等模式植物向其他植物拓展应用,实现多组织多样本的研究。目前,番茄、茶树和花生 (Arachis hypogaea) 已成功应用植物 scRNA-seq 技术,预示着植物细胞遗传研究将进入一个单细胞时代。未来,跨物种 scRNA-seq 联合分析能够实现不同植物物种细胞类型进化和发育关系的研究。与此同时,随着单细胞多组学的出现,单细胞转录组将会和空间转录组、基因组、蛋白组学等多种组学相互结合,实现对不同时空尺度上的植物发育规律解析以及了解植物组织中不同细胞间相互作用机制。相较于动物、医学等领域,植物 scRNA-seq 技术仍存在不少挑战,但可以毫不夸张地说,scRNA-seq 为植物细胞的精细化研究带来了新的视野,尤其成为植物组织发育研究的有效途径。
参考文献
- Ma Q, Bücking H, Gonzalez Hernandez JL, Subramanian S. Single-Cell RNA Sequencing of Plant-Associated Bacterial Communities. Front Microbiol. 2019 Oct 29;10:2452. doi: 10.3389/fmicb.2019.02452. PMID: 31736899; PMCID: PMC6828647.
- Bawa G, Liu Z, Yu X, Qin A, Sun X. Single-Cell RNA Sequencing for Plant Research: Insights and Possible Benefits. Int J Mol Sci. 2022 Apr 19;23(9):4497. doi: 10.3390/ijms23094497. PMID: 35562888; PMCID: PMC9100049.
- Mo, Y. and Jiao, Y. (2022). Advances and applications of single‐cell omics technologies in plant research. The Plant Journal, 110(6), 1551-1563. https://doi.org/10.1111/tpj.15772.
- 苗龙,汪文辉,何艮华,李佳佳,高慧慧,王晓波,邱丽娟。单细胞转录组测序在植物组织发育研究中的应用 [J]. 农业生物技术学报,2023,31(07):1522-1533.
- Islam MT, Liu Y, Hassan MM, Abraham PE, Merlet J, Townsend A, Jacobson D, Buell CR, Tuskan GA, Yang X. Advances in the Application of Single-Cell Transcriptomics in Plant Systems and Synthetic Biology. Biodes Res. 2024 Feb 29;6:0029. doi: 10.34133/bdr.0029. PMID: 38435807; PMCID: PMC10905259.
- Luecken MD, Theis FJ. Current best practices in single-cell RNA-seq analysis: a tutorial. Mol Syst Biol. 2019 Jun 19;15(6):e8746. doi: 10.15252/msb.20188746. PMID: 31217225; PMCID: PMC6582955.
- Iqbal MM, Hurgobin B, Holme AL, Appels R, Kaur P. Status and Potential of Single-Cell Transcriptomics for Understanding Plant Development and Functional Biology. Cytometry A. 2020 Oct;97(10):997-1006. doi: 10.1002/cyto.a.24196. Epub 2020 Aug 28. PMID: 32713117.
- 李益,孙超。植物单细胞转录组测序研究进展。生物技术通报 [J], 2021, 37(1): 60-66 doi:10.13560/j.cnki.biotech.bull.1985.2020-1011.
- Liao RY, Wang JW. Analysis of meristems and plant regeneration at single-cell resolution. Curr Opin Plant Biol. 2023 Aug;74:102378. doi: 10.1016/j.pbi.2023.102378. Epub 2023 May 10. PMID: 37172363.
- 张舒婷,张雪莹,朱晨,李卓蕴,傅卓然,张梓浩,赖钟雄,林玉玲。单细胞转录组测序技术及其在植物中的应用 [J]. 园艺学报,2022,49(10):2163-2173.
- Liu Z, Yu X, Qin A, Zhao Z, Liu Y, Sun S, Liu H, Guo C, Wu R, Yang J, Hu M, Bawa G, Sun X. Research strategies for single-cell transcriptome analysis in plant leaves. Plant J. 2022 Oct;112(1):27-37. doi: 10.1111/tpj.15927. Epub 2022 Aug 16. PMID: 35904970.
- 张在宝,赵紫微,张佩欣,叶凡,罗天。单细胞测序技术在植物中的应用研究进展 [J]. 信阳师范学院学报(自然科学版),2023,36(02):330-337.
- Lin S, Liu Y, Zhang M, Xu X, Chen Y, Zhang H, Yang C. Microfluidic single-cell transcriptomics: moving towards multimodal and spatiotemporal omics. Lab Chip. 2021 Oct 12;21(20):3829-3849. doi: 10.1039/d1lc00607j. PMID: 34541590.
- Garavello M, Cuenca J, Dreissig S, Fuchs J, Houben A, Aleza P. Assessing Ploidy Level Analysis and Single Pollen Genotyping of Diploid and Euploid Citrus Genotypes by Fluorescence-Activated Cell Sorting and Whole-Genome Amplification. Front Plant Sci. 2019 Sep 24;10:1174. doi: 10.3389/fpls.2019.01174. PMID: 31611896; PMCID: PMC6769063.
- Rosenberg AB, Roco CM, Muscat RA, Kuchina A, Sample P, Yao Z, Graybuck LT, Peeler DJ, Mukherjee S, Chen W, Pun SH, Sellers DL, Tasic B, Seelig G. Single-cell profiling of the developing mouse brain and spinal cord with split-pool barcoding. Science. 2018 Apr 13;360(6385):176-182. doi: 10.1126/science.aam8999. Epub 2018 Mar 15. PMID: 29545511; PMCID: PMC7643870.
- Picelli S, Björklund ÅK, Faridani OR, Sagasser S, Winberg G, Sandberg R. Smart-seq2 for sensitive full-length transcriptome profiling in single cells. Nat Methods. 2013 Nov;10(11):1096-8. doi: 10.1038/nmeth.2639. Epub 2013 Sep 22. PMID: 24056875.
- Liu Z, Zhou Y, Guo J, Li J, Tian Z, Zhu Z, Wang J, Wu R, Zhang B, Hu Y, Sun Y, Shangguan Y, Li W, Li T, Hu Y, Guo C, Rochaix JD, Miao Y, Sun X. Global Dynamic Molecular Profiling of Stomatal Lineage Cell Development by Single-Cell RNA Sequencing. Mol Plant. 2020 Aug 3;13(8):1178-1193. doi: 10.1016/j.molp.2020.06.010. Epub 2020 Jun 24. PMID: 32592820.
- Liu Z, Wang J, Zhou Y, Zhang Y, Qin A, Yu X, Zhao Z, Wu R, Guo C, Bawa G, Rochaix JD, Sun X. Identification of novel regulators required for early development of vein pattern in the cotyledons by single-cell RNA-sequencing. Plant J. 2022 Apr;110(1):7-22. doi: 10.1111/tpj.15719. Epub 2022 Mar 16. PMID: 35218590; PMCID: PMC9310732.
- Kurimoto K, Yabuta Y, Ohinata Y, Ono Y, Uno KD, Yamada RG, Ueda HR, Saitou M. An improved single-cell cDNA amplification method for efficient high-density oligonucleotide microarray analysis. Nucleic Acids Res. 2006 Mar 17;34(5):e42. doi: 10.1093/nar/gkl050. PMID: 16547197; PMCID: PMC1409679.
- Islam S, Kjällquist U, Moliner A, Zajac P, Fan JB, Lönnerberg P, Linnarsson S. Characterization of the single-cell transcriptional landscape by highly multiplex RNA-seq. Genome Res. 2011 Jul;21(7):1160-7. doi: 10.1101/gr.110882.110. Epub 2011 May 4. PMID: 21543516; PMCID: PMC3129258.
- Takahashi N, Umeda M. Brassinosteroids are required for efficient root tip regeneration in Arabidopsis. Plant Biotechnol (Tokyo). 2022 Mar 25;39(1):73-78. doi: 10.5511/plantbiotechnology.21.1103a. PMID: 35800959; PMCID: PMC9200090.
- Denyer T, Ma X, Klesen S, Scacchi E, Nieselt K, Timmermans MCP. Spatiotemporal Developmental Trajectories in the Arabidopsis Root Revealed Using High-Throughput Single-Cell RNA Sequencing. Dev Cell. 2019 Mar 25;48(6):840-852.e5. doi: 10.1016/j.devcel.2019.02.022. PMID: 30913408.
- Bai Y, Liu H, Lyu H, Su L, Xiong J, Cheng ZM. Development of a single-cell atlas for woodland strawberry (Fragaria vesca) leaves during early Botrytis cinerea infection using single cell RNA-seq. Hortic Res. 2022 Jan 19;9:uhab055. doi: 10.1093/hr/uhab055. Epub ahead of print. PMID: 35043166; PMCID: PMC8969069.